ساختار مواد
اتم ها مطابق مدل بور ( Bohr model ) دارای ساختار نجومی ( Planetary structure ) هستند. نوترونها و پروتونها با هم در مرکز اتم قرار دارند که هسته نامیده می شود. الکترون ها در اطراف هسته مطابق الگوی خاص خود می چرخند. در این مدل الکترون ها نقش سیاره ها و هسته نقش خورشید را بازی میکند.
تعداد پروتونها در یک اتم عدد اتمی ( Atomic number ) را مشخص میکنند. وزن اتمی ( Atomic weight ) تقریباً برابر تعداد پروتون ها بعلاوه تعداد نوترون ها است. الکترون ها در مدارها و یا لایه های با فاصله مشخص از هسته اتم به دور آن میچرخند. هر لایه دارای ۲n2 الکترون است که در آن n شماره لایه است با این استثناء که تعداد الکترون های آخرین لایه که به لایه ظرفیت مشهور است به ۸ الکترون محدود می شود. هر لایه دارای یک انرژی مشخص متناظر با آن است. هر چه لایه به هسته نزدیکتر باشد نیرویی که آنرا به هسته مقید میکند بیشتر است. بدین معنی که الکترونهای لایه اول تحت کشش شدید هسته هستند در حالی که به الکترونهای لایه آخر کمتر نیرو وارد میشود. الکترونهای آخرین لایه که بیشتر امکان فرار کردن از هسته را دارند مسئول انجام واکنشهای شیمیایی و همچنین هدایت الکتریکی هستند. الکترونهای لایه آخر، الکترون های ظرفیت نامیده می شوند. الکترونهای ظرفیت که در آخرین لایه می چرخند دارای بالاترین سطح انرژی هستند و برای جدا شدن از اتم مقدار انرژی کمی نیاز دارند. لایههای انرژی نزدیکتر به هسته سطح انرژی کمتری دارند. شکل زیر مفهوم سطح انرژی را نشان میدهد.
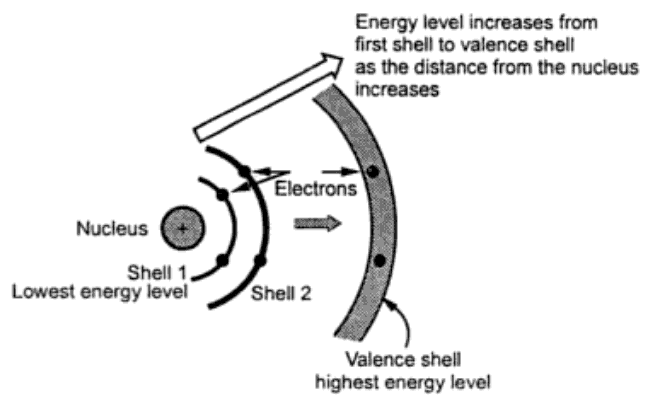
هنگامی که یک اتم از یک منبع گرمایی و یا از نور انرژی دریافت می کند سطح انرژی الکترونها افزایش مییابد. هنگامی که سطح انرژی الکترون افزایش می یابد به مدار بالاتر می رود که از هسته دورتر است. چنانچه الکترونهای ظرفیت از این انرژی بهرهمند شوند می خواهند به مدار بالاتر پرش نمایند و چون در آخرین مدار قرار دارند بنابراین کلاً از جاذبه هسته اتم خارج میشوند و تبدیل به الکترون آزاد می شوند که کار هدایت جریان الکتریکی را انجام می دهد. هر چه تعداد الکترونهای آزاد بیشتر باشد هدایت الکتریکی ماده بیشتر خواهد بود.
تئوری باند انرژی ( Energy-band theory )
الکترونهای لایه ظرفیت بالاترین سطح انرژی الکترونهای یک اتم را دارا هستند و کمتر از بقیه تحت جاذبه هسته اتم هستند. این الکترونها عمل ترکیب شیمیایی و پیوند با اتم های مجاور را بعهده دارند. در مواد جامد اتمها به یکدیگر بسیار نزدیک هستند و عملاً الکترونهای لایه آخر بین چند اتم مشترک هستند. بنابراین الکترونهای لایه آخر از نیروهای مربوط به چند اتم تاثیر میپذیرند. پیوند تشکیل شده در اثر اشتراک الکترون های ظرفیت اتم های مجاور با یکدیگر را پیوند هم ظرفیت گویند. بنابراین الکترونهای ظرفیت بدلیل آنکه در پیوند هم ظرفیت اتم های مجاور هستند آزاد نخواهند بود.
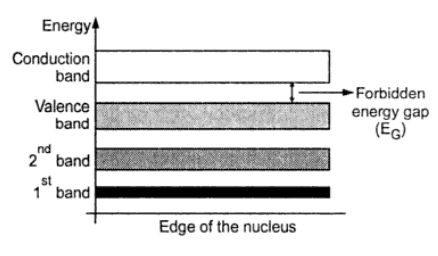
الکترونهای ظرفیت دارای بالاترین سطح انرژی هستند و بدلیل آنکه تشکیل پیوند هم ظرفیت میدهند سطوح انرژی متناظر با الکترونهای ظرفیت با یکدیگر ادغام میشود. این ادغام یک باند انرژی ( Energy band ) را شکل میدهد. بصورت مشابه سطوح انرژی الکترون های موجود در مدارهای اول، دوم و … ادغام می شوند تا باندهای انرژی مختلفی را شکل دهند. بنابراین برخلاف آنکه در اتم های جدا از هم سطوح انرژی کاملاً مجزایی وجود دارد، سطوح انرژی با فاصله کم در جامدات وجود دارد که به آنها باندهای انرژی می گوییم. از میان همه باندهای انرژی ، سه باند انرژی به شرح زیر از اهمیت زیادی برخوردار است.
الف) باند ظرفیت که از ادغام سطوح انرژی متناظر با الکترون های ظرفیت تشکیل می شود .
ب) باند هدایت ( Conduction band ) که از ادغام سطوح انرژی متناظر با الکترون های آزاد تشکیل می شود .
در حالت عادی باند هدایت خالی است و با دادن انرژی الکترون های ظرفیت به باند هدایت پرش می کنند و آزاد میشوند. هنگام پریدن از باند ظرفیت به باند هدایت، الکترون ها بایستی از یک گپ یا فاصله انرژی عبور نمایند.
ج) باند ممنوع ( Forbidden band or gap ) : گپ انرژی که باند ظرفیت را از باند هدایت جدا میکند، گپ یا باند ممنوع نامیده می شود و با EG نشان داده می شود. الکترونها نمیتوانند در باند ممنوع حضور داشته باشند. انرژی داده شده به الکترونهای ظرفیت بایستی از باند ممنوع بیشتر باشد تا آنها بتوانند از باند ظرفیت به باند هدایت وارد شوند. شکل زیر دیاگرام باند انرژی مواد جامد را نشان می دهد.
 همانگونه که میدانید در سیستم واحدهای M.K.S. واحد انرژی ژول است. اما این واحد برای بیان سطح انرژی الکترونها بسیار بزرگ است. بنابراین از یک واحد انرژی دیگر بنام الکترون ولت eV استفاده می نماییم. طبق تعریف یک الکترون ولت انرژی لازم برای عبور یک الکترون از پتانسیل یک ولتی است. بنابراین
همانگونه که میدانید در سیستم واحدهای M.K.S. واحد انرژی ژول است. اما این واحد برای بیان سطح انرژی الکترونها بسیار بزرگ است. بنابراین از یک واحد انرژی دیگر بنام الکترون ولت eV استفاده می نماییم. طبق تعریف یک الکترون ولت انرژی لازم برای عبور یک الکترون از پتانسیل یک ولتی است. بنابراین
![]()
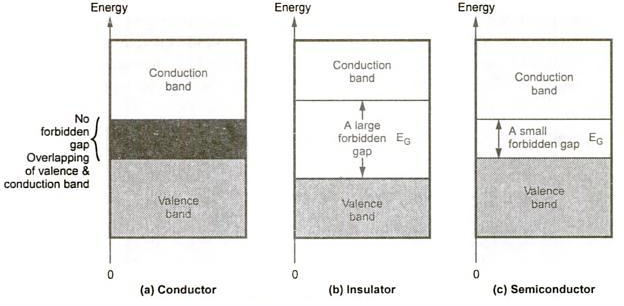
برای مواد هادی باند ممنوعه وجود ندارد و باند ظرفیت با باند هدایت همپوشانی دارد. برای مواد عایق باند ممنوع بسیار بزرگ و حدود ۷ الکترون ولت است بگونهای که امکان پرش برای الکترونهای ظرفیت از باند ظرفیت به باند هدایت وجود ندارد مگر در دماها یا ولتاژهای خیلی بالا که به آن ولتاژ شکست عایقی گفته می شود. مواد نیمه هادی دارای گپ ممنوعه نازک و در حدود یک الکترون ولت هستند. در این مواد حرارت موجود در دمای اتاق کافی است که الکترون ها را از باند ظرفیت به باند هدایت بالا ببرد. اما در دمای صفر کلوین یا ۲۷۳- درجه سلسیوس کلیه الکترون ها در باند ظرفیت قفل شدهاند و عنصر مثل یک عایق کامل عمل میکند. گپ ممنوعه برای نیمه هادی ها با درجه حرارت تغییر می کند. بعنوان نمونه نیمه هادی سیلیسیوم و ژرمانیوم مطابق روابط زیر با دما تغییر میکند که در آن T دمای مطلق برحسب کلوین و EG برحسب الکترون ولت است.
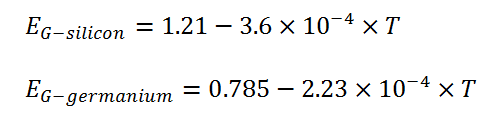
معرفی نیمه هادی های از نوع p و n
اتم از بارهای الکتریکی مثبت و منفی به میزان برابر تشکیل شده و از نظر الکتریکی خنثی است. پروتونها بارهای الکتریکی مثبت را تشکیل داده و در هسته اتم قرار میگیرند. الکترونها در مدارهای مختلف اطراف هسته می چرخند.
یک عنصر در صورت کامل بودن تعداد الکترونهای آخرین لایه (shell) پایدار نامیده میشود. ظرفیت کامل لایه اول ۲ الکترون، لایه دوم ۸ الکترون، لایه سوم ۱۸ الکترون، لایه چهارم ۳۲ الکترون و . . . است. تعداد الکترونهای آخرین لایه، شماره گروه آن عنصر را نشان میدهد. جدول (۲-۱) جدول تناوبی عناصر را نشان میدهد.
بعنوان مثال عنصر سیلیسیم (Si) در لایه اول دارای ۲ الکترون، لایه دوم ۸ الکترون و لایه سوم ۴ الکترون است. یعنی دو لایه اول کامل است ولی لایه بیرونی که لایه ظرفیت است با داشتن ۴ الکترون نیمه پر است. اتم ژرمانیوم با در اختیار داشتن ۱۸ الکترون به لایه سوم در لایه چهارم دارای ۴ الکترون است. بنابراین سیلیسیم و ژرمانیوم از گروه چهار است و میتواند الکترون های لایه ظرفیت را با اتمهای مجاور تقسیم نماید. هر عنصری که در لایه ظرفیت آن از ۴ الکترون تشکیل شده باشد یک نیمه هادی ذاتی یا خالص ( Pure or intrinsic semiconductor ) نامیده میشود. شکل زیر ساختمان اتمی سیلیسیم و ژرمانیوم را نشان می دهد.
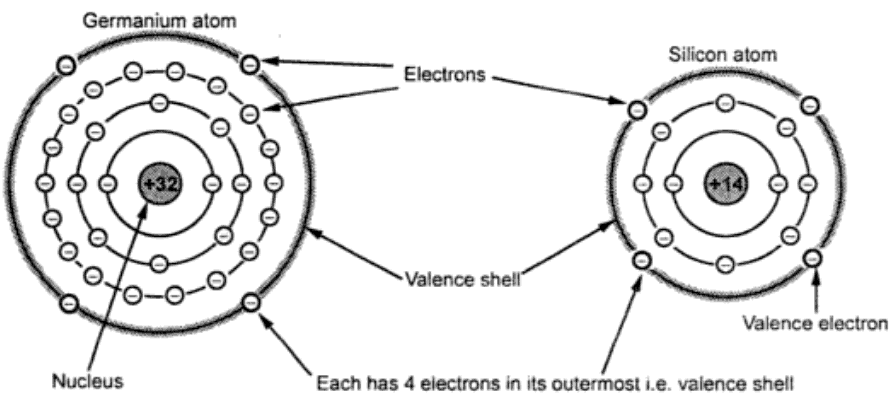
الکترونهای ظرفیت سیلیسیوم در لایه سوم و برای ژرمانیوم در لایه چهارم قرار دارند بنابراین الکترونهای ظرفیت ژرمانیوم کمتر در جاذبه هسته قرار داشته و در دماهای بالا ناپایدارتر از سیلیسیوم هستند. بهمین دلیل در ساخت نیمه هادیها بیشتر از سیلیسیم استفاده میشود.
انرژی دادن به سیلسیم خالص مثلاً از نوع حرارتی منتج به آزاد شدن الکترون از لایه آخر میشود. این عمل سبب هادی شدن سیلیسیم میشود که به آن هدایت ذاتی (intrinsic conduction) گویند. ناخالصی در نیمه هادی ذاتی بسیار کم و از مرتبه یک در ۱۰۰ میلیون است.
افزودن ناخالصی به سیلسیم میتواند موجب هدایت غیرذاتی (extrinsic conduction) شود. اتم سیلیسیم همیشه در جستجوی راهی برای پر کردن لایهی آخر است تا ۸ الکترونش را کامل کند. برای انجام این کار، این الکترو نها را با ۴ تا از اتم های سیلیکون همسایه اش شریک خواهد کرد. هر اتم تمایل دارد که موقعیت خود را با اتم های همسایه اش حفظ کند، در نتیجه هر اتم از ۴ سمت به ۴ همسایهاش متصل می شود. وقتی انرژی به سیلیکون خالص اضافه می شود (مثلاً به صورت گرما)، می تواند موجب شود که پیوند تعدادی از الکترون ها شکسته شود و اتم هایشان را ترک کنند و یک حفره در هر نمونه بوجود آید. سپس این الکترونها، به طور اتفاقی پیرامون شبکه ی بلوری پراکنده می شوند و حفره ی دیگری را جستجو می کنند که درون آن سقوط کنند. این الکترون ها حاملهای آزاد نامیده می شوند و می توانند جریان الکتریکی را جا به جا کنند. اما تعداد کمی از آن ها در سیلیکون خالص وجود دارند و خیلی مفید نیستند.
هنگامی که یک اتم الکترون از دست می دهد بار خالص آن مثبت است که به آن یون مثبت و هنگامی که یک الکترون دریافت میکند به آن یون منفی گویند. به فرایندی که منجر به تشکیل یونهای مثبت و منفی می شود یونیزاسیون ( Ionization ) گویند .
سیلیکون ناخالص که با اتمهای فسفر ترکیب شده است، داستانی متفاوت دارد. انرژی بسیار کمتری برای ضربه زدن به یکی از الکترون های سست و اضافی فسفر، صرف می شود. چرا که آن ها در یک پیوند، مقید نشده اند و همسایگانشان مانع آنها نیستند. به همین خاطر بیشتر این الکترون ها با دریافت انرژی آزاد می شوند و در نتیجه نسبت به سیلیکون خالص، حامل های آزاد بسیار بیشتری در سیلیکون نا خالص داریم. این فرایند را ناخالصسازی گویند. سیلیکون بدست آمده بدلیل پخش الکترون های آزاد، نوع N (Negative) نامیده میشود. سیلیکون آلاییده ی نوع N به دلیل پخش الکترو نهای آزاد رسانای بسیار بهتری نسبت به سیلیکون خالص است. در واقع فقط بخشی از سلول خورشیدی از نوع آلاییده N است. سایر قسمت ها با بور آلائیده می شود که به جای ۴ الکترون فقط ۳ الکترون در لایه ی بیرونی خود دارد. بدین ترتیب سیلیکون نوع P بدست می آید. سیلیکون نوع P به جای داشتن الکترون های آزاد، حفره ی آزاد دارد. حفره ها در واقع فقدان الکترون ها هستند. پس آن ها بار قرینه مثبت حمل می کنند. بر این اساس و طبق خواص فیزیکى لایه چهارم جدول مندلیف با آلائیدن و اعمال ناحالصی مانند بور و فسفر به ماده ی اصلی می توان لایه نازک از نوع P و N تهیه نمود. وقتی حفره ها و الکترون ها در پیوندگاه بین سیلیکون نوع P و N ترکیب شوند، خنثایی از دست می رود. در نهایت یک میدان الکتریکی جداگانه ی دوجانبه بوجود می آید. شرح زیر مراحل این نوع هدایت را توضیح میدهد.
الف) افزودن ناخالصی از گروه V (دهنده الکترون) باعث فزونی الکترون در نیمه هادی شده و دوپینگ ( Doping ) از نوع n را ایجاد میکند. در این حالت الکترونها حاملهای اکثریت و حفره ها حاملهای اقلیت هستند.
ب) افزودن ناخالصی از گروه III (گیرنده الکترون) موجب کمبود الکترون در نیمه هادی شده و دوپینگ ( Doping ) از نوع p را ایجاد می کند. در این حالت حفره ها حامل اکثریت و الکترون ها حامل های اقلیت هستند.
پیوند PN
شکل زیر ساختمان یک پیوند حاصل از اتصال نیمه هادی نوع N با نیمه هادی نوع P را نشان میدهد.
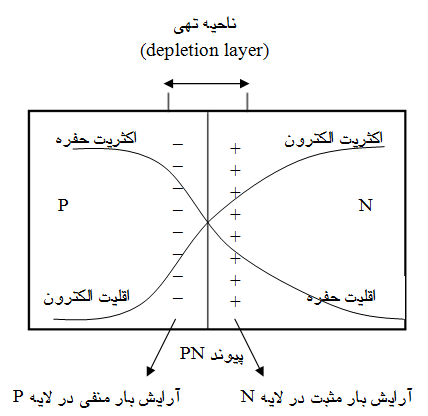
عملکرد ناحیه تهی نزدیک به عایق است. ولتاژ ایجاد شده در ناحیه تهی برای نیمه رسانای سیکیون تقریباً برابر ۵۶۰ میلی ولت است. اتصال باطری در جهت مستقیم مطابق شکل زیر بایاس مستقیم (forward) پیوند PN می شود.
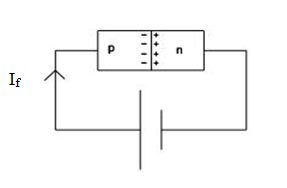
نتیجه این نوع اتصال کوچک شدن ناحیه تهی و عبور جریان به معادله
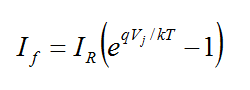
خواهد بود که در آن IR جریان معکوس، Vj ولتاژ پیوند،q بار الکترون، T دمای مطلق و k ثابت بولتزمن است .
اتصال باطری در جهت معکوس نیز مطابق شکل زیر موجب بایاس معکوس (reverse ) اتصال PN می شود.
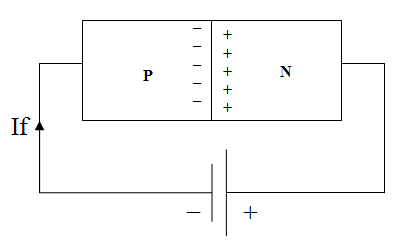
نتیجه این نوع اتصال بزرگتر شدن ناحیه تهی و ممانعت از عبور جریان است. در عمل عبور جریان کوچکی مشاهده می شود که به آن جریان نشتی (leakage current) گفته می شود .
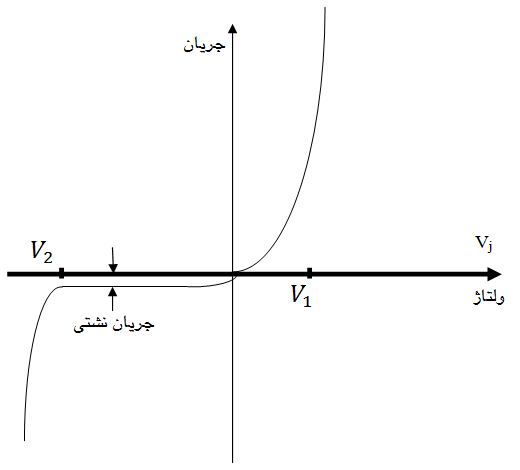
شکل زیر نمودار جریان – ولتاژ پیوند را در حالت بایاس مستقیم و بایاس معکوس نشان می دهد.
مقادیر عناصر (rating)
اندازههای حداکثر است که یک عنصر بدون خراب شدن می تواند تحمل کند مقادیر (rating) آن عنصر نامیده می شود. این اندازه ها از جمله پارامترهای محدود کننده است. مهمترین مقادیر عناصر عبارتند از:
- ولتاژ حداکثر معکوس
- ولتاژ حداکثر معکوس تکرار شونده
- ولتاژ مستقیم حداکثر (برای کلیدهای کنترل پذیر)
- جریان مستقیم متوسط حداکثر IF(AV)
- جریان مستقیم موثر حداکثر IF(RMS)
- جریان حداکثر گذرای غیر تکراری مجاز
- تلفات توان حداکثر
- دمای حداکثر پیوند برحسب درجه سلسیوس ( oC ) (Junction Temperature)
- دمای بهره برداری (operating temperature)
- دمای ذخیره (Storage Temperature)
- نرخ زمانی افزایش جریان حداکثر
مشخصات دیودها (characteristics)
کارآیی عنصر تحت شرایط خاص مشخصات عنصر نامیده می شود. مشخصات را می توان پارامترهای توصیفی عناصر نامید. مشخصات عنصر شامل دو دسته مشخصات استاتیک و دینامیک به شرح زیر است.
الف) مشخصات استاتیک :
- حداکثر افت ولتاژ مستقیم
- حداکثر جریان نشتی معکوس
- حداکثر تلفات توان مستقیم
- تلفات توان معکوس
- بهره توانی عنصر (توان کنترل شده به توان مورد نیاز برای فرمان)
- مشخصه فیوزی I2t
- مقاومت حرارتی پیوند به بدنه و برای قطعات قابل اتصال به خنک کننده و پیوند به هوا برای قطعات با پکیج غیر قابل اتصال به خنک کننده ( oC/W )
ب) مشخصات دینامیک :
- زمان کلید زنی یا مدت زمانی که برای یک روشن شدن و خاموش شدن متوالی نیاز است. زمان کلید زنی بالا موجب ایجاد تلفات زیاد در کاربردهای با فرکانس بالا می شود. (حداکثر فرکانس کاری)
- حداکثر نرخ افزایش ولتاژ در جهت مستقیم بدون روشن شدن ناخواسته
- ظرفیت خازنی پیوند
- زمان روشن شدن ton
- زمان بازیابی معکوس ( trr ) یا زمان خاموش شدن toff
منبع : جزوه الکترونیک صنعتی دکتر صادق زاده ( هیئت علمی دانشگاه شاهد )
در صورتی که این مطلب مورد پسندتان واقع شد لایک و اشتراک گذاری فراموش نشود.



دیدگاهتان را بنویسید